O Mundo Das Reações De Oxirredução Na Química Orgânica se revela um universo fascinante, onde elétrons dançam em uma coreografia precisa, moldando moléculas e desenhando os caminhos da síntese orgânica. Nesta jornada, exploraremos a arte da oxidação e redução, desvendando os mecanismos que governam essas transformações fundamentais. De álcoois a aldeídos, de cetonas a ácidos carboxílicos, acompanharemos a metamorfose da matéria, testemunhando a elegância e a potência dessas reações que constroem a base da química moderna.
Prepare-se para mergulhar neste mundo intrigante, onde a dança dos elétrons conduz a criação de novas moléculas e a transformação da matéria orgânica.
Aprenderemos a identificar e utilizar diferentes agentes oxidantes e redutores, compreendendo suas seletividades e aplicações específicas. Desvendaremos os mecanismos intrincados por trás dessas reações, utilizando a linguagem precisa das setas curvas para visualizar o fluxo de elétrons. Veremos como essas reações são peças-chave na construção de moléculas complexas, abrindo portas para a síntese de fármacos, polímeros e inúmeros outros compostos essenciais à nossa sociedade.
A jornada pela química orgânica se torna ainda mais rica e significativa quando compreendemos o poder transformador das reações de oxirredução.
Conceitos Fundamentais em Reações de Oxirredução Orgânica
A dança eletroquímica da vida orgânica! Oxidação e redução, conceitos aparentemente abstratos, revelam-se como os atores principais em uma vasta gama de transformações químicas que moldam o mundo ao nosso redor, desde a respiração celular até a síntese de fármacos complexos. Neste palco molecular, o movimento de elétrons é a coreografia, e a compreensão de suas nuances é a chave para desvendar os segredos da química orgânica.
Oxidação e Redução em Compostos Orgânicos
Em química orgânica, oxidação e redução transcendem a simples perda ou ganho de elétrons, assumindo um significado mais amplo, ligado à variação do estado de oxidação de átomos de carbono. Oxidação implica um aumento no estado de oxidação do carbono, geralmente associado ao aumento do número de ligações carbono-oxigênio ou diminuição do número de ligações carbono-hidrogênio. Por exemplo, a oxidação de um álcool primário a um aldeído envolve a perda de dois átomos de hidrogênio do carbono alfa, aumentando seu estado de oxidação.
Já a redução representa o processo inverso, com diminuição do estado de oxidação do carbono, frequentemente associada ao aumento do número de ligações carbono-hidrogênio ou diminuição do número de ligações carbono-oxigênio. A redução de uma cetona a um álcool secundário ilustra este princípio, com o ganho de dois átomos de hidrogênio no carbono carbonílico. Observe a transformação do etanol (CH 3CH 2OH) em ácido acético (CH 3COOH) como uma oxidação, e a conversão de propanona (CH 3COCH 3) em propan-2-ol (CH 3CH(OH)CH 3) como uma redução.
Agentes Oxidantes e Redutores em Química Orgânica
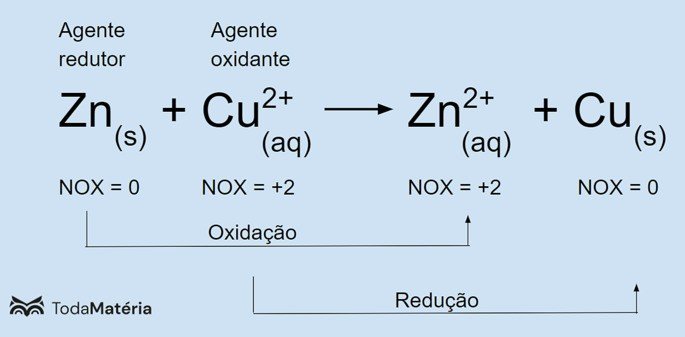
A orquestração dessas reações redox orgânicas depende de agentes oxidantes e redutores cuidadosamente selecionados. Os agentes oxidantes, como o permanganato de potássio (KMnO 4), o dicromato de potássio (K 2Cr 2O 7) e o reagente de Collins (PCC), são espécies químicas capazes de “roubar” elétrons de um substrato orgânico, promovendo sua oxidação. Cada um possui sua própria seletividade e aplicabilidade, dependendo da estrutura do substrato e do produto desejado.
Por outro lado, os agentes redutores, como o hidreto de lítio e alumínio (LiAlH 4), o borohidreto de sódio (NaBH 4) e o hidrogênio em presença de um catalisador de paládio (H 2/Pd), doam elétrons, conduzindo à redução do substrato orgânico. A escolha do agente redutor depende da funcionalidade a ser reduzida e da sensibilidade do substrato a condições mais ou menos drásticas.
Por exemplo, LiAlH 4 é um agente redutor muito potente, capaz de reduzir ésteres e ácidos carboxílicos, enquanto NaBH 4 é mais suave e reduz preferencialmente cetonas e aldeídos.
Comparação de Métodos de Oxidação e Redução
A escolha do reagente ideal depende de fatores como a seletividade e a aplicabilidade em diferentes contextos sintéticos. A tabela a seguir ilustra as características de alguns métodos comuns:
| Método de Oxidação | Seletividade | Aplicabilidade | Limitações |
|---|---|---|---|
| KMnO4 | Geralmente forte, pode levar à clivagem de ligações C=C | Oxidação de álcoois, alcenos | Pode ser muito reativo, levando a produtos secundários |
| K2Cr2O7 | Moderada, pode oxidar álcoois primários a ácidos carboxílicos | Oxidação de álcoois | Menos reativo que KMnO4, mas ainda pode ser agressivo |
| PCC | Alta, oxida álcoois primários a aldeídos | Oxidação seletiva de álcoois primários a aldeídos | Menos reativo que KMnO4 e K2Cr2O7 |
| Método de Redução | Seletividade | Aplicabilidade | Limitações |
|---|---|---|---|
| LiAlH4 | Forte, reduz diversos grupos funcionais | Redução de ésteres, ácidos carboxílicos, cetonas, aldeídos | Muito reativo, sensível à água e ao ar |
| NaBH4 | Moderada, reduz cetonas e aldeídos | Redução de cetonas e aldeídos | Menos reativo que LiAlH4 |
| H2/Pd | Alta, redução de ligações C=C | Redução de alcenos, alcinos | Requer condições específicas de pressão e temperatura |
Mecanismos de Reações de Oxirredução em Química Orgânica: O Mundo Das Reações De Oxirredução Na Química Orgânica

A dança dos elétrons, um balé invisível aos olhos, mas crucial para a transformação da matéria orgânica. Oxidações e reduções, processos aparentemente opostos, são, na verdade, duas faces da mesma moeda, interdependentes e essenciais para a riqueza da química orgânica. Neste capítulo, desvendaremos os mecanismos intrincados que regem essas transformações, observando o fluxo de elétrons como um fio condutor que tece a trama das reações.
Oxidação de Álcoois Primários e Secundários
A oxidação de álcoois, uma transformação clássica na química orgânica, revela a elegância dos mecanismos reacionais. Álcoois primários, com seu grupo hidroxila (-OH) ligado a um carbono primário, e álcoois secundários, com o -OH em um carbono secundário, seguem caminhos distintos rumo à oxidação, guiados pela natureza dos seus átomos de carbono.No caso dos álcoois primários, a oxidação, frequentemente mediada por reagentes como o dicromato de potássio (K 2Cr 2O 7) em meio ácido, procede em duas etapas.
Primeiro, o átomo de oxigênio do álcool ataca o átomo de cromo(VI) do reagente oxidante, enquanto um par de elétrons da ligação C-O migra para o carbono, formando um íon alcóxido. Simultâneamente, uma ligação Cr-O se forma, e um íon hidrogênio é liberado. Em seguida, um segundo equivalente do reagente oxidante promove a oxidação do íon alcóxido ao aldeído, com a perda de um segundo íon hidrogênio.
O aldeído pode sofrer oxidação posterior, transformando-se em um ácido carboxílico. O mecanismo pode ser representado esquematicamente com setas curvas que mostram o movimento dos elétrons. Por exemplo, a oxidação do etanol a ácido acético envolve a transferência de elétrons do etanol para o íon dicromato, que é reduzido.
Exemplo: A oxidação do etanol (CH3CH 2OH) a etanal (CH 3CHO) e posteriormente a ácido acético (CH 3COOH) envolve a transferência de elétrons do álcool para o agente oxidante.
A oxidação de álcoois secundários, por sua vez, leva à formação de cetonas. Aqui, o processo é mais direto, envolvendo a transferência de dois elétrons do álcool para o agente oxidante, resultando na formação de uma ligação dupla carbono-oxigênio (C=O) na cetona. O mecanismo é semelhante ao da oxidação de álcoois primários, mas sem a possibilidade de uma segunda oxidação.
Reagentes como o ácido crômico (H 2CrO 4) são comumente utilizados.
Redução de Cetonas e Aldeídos
A redução de cetonas e aldeídos, o reverso da oxidação de álcoois, é uma transformação igualmente importante na química orgânica. A redução, essencialmente, envolve a adição de hidrogênio (H 2) ou elétrons equivalentes à ligação carbono-oxigênio (C=O), quebrando a dupla ligação e formando uma ligação simples C-O, gerando um álcool. A escolha do reagente redutor influencia o mecanismo e a eficiência da reação.O hidreto de alumínio e lítio (LiAlH 4), um poderoso agente redutor, doa um íon hidreto (H –) ao carbono carbonílico, quebrando a dupla ligação e formando uma ligação C-H.
O íon alcóxido resultante é então protonado, formando o álcool. O borohidreto de sódio (NaBH 4), um redutor mais suave, também doa um íon hidreto, mas é menos reativo que o LiAlH 4, sendo seletivo para cetonas e aldeídos e não reagindo com outras funções presentes na molécula. A reação com ambos os reagentes geralmente segue um mecanismo de adição nucleofílica ao grupo carbonila.
Oxidação de Alcenos a Diálcoois, O Mundo Das Reações De Oxirredução Na Química Orgânica

A transformação de um alceno em um diálcool, um processo que adiciona dois grupos hidroxila (-OH) à dupla ligação carbono-carbono, é um exemplo elegante de oxidação em química orgânica. Esta oxidação, geralmente realizada com permanganato de potássio (KMnO 4) em meio básico, segue um mecanismo que envolve a formação de um intermediário cíclico.
Fluxograma da oxidação de um alceno a um diálcool:
- Ataque nucleofílico do íon permanganato (MnO4–) à dupla ligação do alceno.
- Formação de um intermediário cíclico de cinco membros (intermediário manganato).
- Hidrólise do intermediário cíclico, levando à formação de um diálcool e à redução do manganês.
Aplicações das Reações de Oxirredução em Síntese Orgânica

A dança elegante dos elétrons, a transferência sutil de cargas, a orquestração precisa de oxidações e reduções: eis a beleza e a potência das reações de oxirredução na síntese orgânica. Elas são as ferramentas essenciais do químico orgânico, permitindo a construção de moléculas complexas a partir de precursores mais simples, abrindo portas para a criação de novas substâncias com propriedades e aplicações inimagináveis.
Através delas, a matéria prima se transforma, moldada pela habilidade do químico, em estruturas intrincadas que sustentam a vida, impulsionam a tecnologia e enriquecem o nosso mundo.As reações de oxirredução são fundamentais na construção de moléculas orgânicas complexas, atuando como pilares em inúmeras rotas sintéticas. Sua importância reside na capacidade de transformar grupos funcionais, alterando a conectividade atômica e a reatividade das moléculas.
Essa versatilidade permite a síntese de uma vasta gama de compostos, desde fármacos e polímeros até produtos naturais e materiais avançados. Imagine-as como os tijolos e a argamassa que constroem os edifícios da química orgânica.
Redução de Cetonas a Álcoois
A conversão de uma cetona em um álcool é uma transformação clássica e amplamente utilizada na síntese orgânica. Esta reação de redução, tipicamente realizada com reagentes como o borohidreto de sódio (NaBH₄) ou o hidreto de alumínio e lítio (LiAlH₄), altera significativamente as propriedades químicas e físicas da molécula. A cetona, com seu grupo carbonila reativo, é transformada em um álcool, com um grupo hidroxila (-OH) menos reativo, abrindo caminho para novas reações e modificações.
A redução da propanona (acetona) a propan-2-ol (isopropanol) utilizando borohidreto de sódio em meio alcoólico é um exemplo textbook dessa transformação: CH₃COCH₃ + NaBH₄ → CH₃CH(OH)CH₃.
Podemos esquematizar a síntese de um álcool específico, o 2-fenil-etanol, a partir da sua correspondente cetona, a acetofenona:
Esquema de Síntese:
1. Reagente
Acetofenona
2. Reagente Redutor
NaBH₄ (borohidreto de sódio)
3. Solvente
Metanol (CH₃OH)
4. Condições
Temperatura ambiente
5. Produto
2-fenil-etanol
A reação ocorre em condições brandas, resultando em alta seletividade e rendimento. A escolha do reagente redutor é crucial para controlar a seletividade da reação, e o conhecimento aprofundado das propriedades de cada reagente é fundamental para o sucesso da síntese.
Transformação de Grupos Funcionais

As reações de oxirredução são ferramentas poderosas para a manipulação precisa de grupos funcionais, permitindo a conversão de um grupo funcional em outro. Essa capacidade é essencial para a síntese de moléculas complexas, pois permite a construção passo a passo de estruturas complexas a partir de precursores mais simples. A oxidação de álcoois a aldeídos ou cetonas, e a redução de ácidos carboxílicos a álcoois são exemplos clássicos dessa versatilidade.
A oxidação de álcoois primários a aldeídos utilizando o reagente de Collins (CrO₃ em piridina) é um exemplo marcante dessa transformação. Já a oxidação de álcoois secundários a cetonas pode ser realizada com diversos reagentes, incluindo o dicromato de potássio (K₂Cr₂O₇) em meio ácido.
A redução de ácidos carboxílicos a álcoois pode ser realizada utilizando o hidreto de alumínio e lítio (LiAlH₄), um poderoso agente redutor que consegue reduzir grupos funcionais mais resistentes.
Através de uma série de reações de oxirredução cuidadosamente selecionadas, é possível transformar uma molécula simples em uma estrutura complexa com propriedades e funções específicas. Essa capacidade é fundamental para a descoberta e desenvolvimento de novos fármacos, materiais e tecnologias. A sintese orgânica, portanto, é uma dança precisa e harmoniosa de oxidações e reduções, uma sinfonia molecular que nos permite criar e modificar a matéria.

